Axit có những loại nào? Tính chất vật lý và hóa học của axit
Axit là gì? Axit có mấy loại ? Axit có những tính chất vật lý, hóa học gì? Axit được ứng dụng vào những lĩnh vực nào của cuộc sống? Chúng ta cần nắm được các kiến thức về axit để sử dụng an toàn nhất. Bài viết dưới đây, Tổng kho hóa chất xin cung cấp tới các bạn những thông tin tin cơ bản nhất về axit.
Contents
Axit là gì?
- Axit là những hợp chất hóa học mà trong thành phần phân tử chứa 1 hay nhiều nguyên tử Hidro link với những gốc axit như Cl, SO4, NO3, PO4 …
- Về mặt khoa học, axit là nhữngphân tử
hay
ioncó năng lực nhườngproton (ion H+
) cho
bazơ, hay nhận ( những ) cặpelectronkhông chia từbazơ.
- Khi hòa tan trong nước, axit tạo nên dung dịch có độ pH nhỏ hơn 7. Axit càng mạnh thì có độ pH càng nhỏ .
Các loại axit
Vjay, axit có những loại nào? Thông thường, người ta phân chia axit theo 2 cách: dựa vào tính chất hóa học và dựa vào số nguyên tử oxy
Dựa vào tính chất hóa học của axit
Dựa vào đặc thù axit của từng loại, axit chia làm axit mạnh và axit yếu
- Axit mạnh khi hòa tan vào nước cho dung dịch có độ pH nhỏ, thấp hơn nhiều so với 7 (
HCL, HNO3, axit sunfuric, …)
- Axit yếu khi hòa tan vào nước cho dung dịch axit có độ pH gần 7 ( H2S. H2CO3, … )

Acid Clohydric, HCl
Dựa vào số nguyên tử oxi
Theo cách này, tất cả chúng ta phân axit thành 2 loại : có oxy và không có oxy trong phân tử .
Axit không có chứa nguyên tử oxi trong cấu trúc phân tử như axit clohydric, H2S, HBr, HI, HF…
Axit có chứa nguyên tử oxi trong cấu trúc phân tử như axit H2SO4, HNO3, H3PO4, H2CO3 …
Phân loại khác
Ngoài ra axit còn hoàn toàn có thể phân loại theo những dạng dưới đây :
Axit vô cơ và hữu cơ như trong đó axit vô cơ như HCl. H2SO4, HS, HNO3 … và các loại axit hữu cơ có gốc COOH như axit axetic, C2H5COOH…
Các sắt kẽm kim loại ở dạng hidrat hóa như Al ( H2O ) 3 3 +, Cu ( H20 ) 2 2 +, Na +, Ba2 +, Ca2 + … .
Các ion như H +, H3O +, NH4 +, RNH3 +, HSO4 -, …
Những tính chất của axit cần nắm vững
Để sử dụng axit an toàn, trước tiên chúng ta cần nắm rõ các tính chất của axit.
Tính chất vật lý
Thông thường, những loại axit có vị chua khi hòa tan trong nước .
Axit hoàn toàn có thể gây bỏng rát, đặc biệt quan trọng là so với những loại axit mạnh hoàn toàn có thể gây ảnh hưởng tác động đến sức khỏe thể chất nếu không được sử dụng đúng cách .
Axit là chất điện li nên có năng lực dẫn điện
Các loại axit thường có sắc tố khác nhau và phụ thuộc vào vào độ đậm đặc của axit đó .
Tính chất hóa học
Một số đặc thù cơ bản của axit gồm có làm đổi màu quỳ tím, năng lực công dụng với sắt kẽm kim loại, bazo, oxit bazo, muối ( những phản ứng trung hòa, phản ứng thế và điện ly )
Axit làm đổi màu giấy quỳ tím
Dung dịch axit có độ pH nhỏ hơn 7 nên làm quỳ tím chuyển màu đỏ .
Axit tác dụng với kim loại
Khi cho dung dịch Axit tính năng với những sắt kẽm kim loại đứng trước nguyên tử H trong dãy hoạt động hóa học ta sẽ nhận được một muối và giải phóng khí hidro. Trong trường hợp axit đậm đặc phối hợp với sắt kẽm kim loại sẽ không giải phóng H2 mà tạo thành nước và 1 số ít loại khí khác như SO2, NO2, NO … Ví dụ :
2N a + 2HC l → 2N aCl + H2 ↑
Mg + H2SO4 ( loãng ) → MgSO4 + H2 ↑
Fe + 2HC l → FeCl2 + H2 ↑
Cu + 2H2 SO4 đ → CuSO4 + SO2 ↑ + H2O
Cu + 4HNO3 đ → Cu ( NO3 ) 2 + 2NO2 ↑ + 2H2 O
3C u + 8HNO3 loãng → 3C u ( NO3 ) 2 + 2NO ↑ + 4H2 O
Tác dụng với bazơ
Axit tác dụng với các Bazơ tạo thành muối và nước. Đây được gọi là phản ứng trung hòa axit, phản ứng này xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí hoặc nước.
Ví dụ :
NaOH + HCl → NaCl + H2O
Mg ( OH ) 2 + 2HC l → MgCl2 + 2H2 O
H2SO4 + Cu ( OH ) 2 → CuSO4 ( dd ) + 2H2 O
Tác dụng với oxit bazơ
Tất cả những axit đều tính năng với oxit bazơ và tạo thành muối + nước
Ví dụ :
Na2O + 2HC l → 2N aCl + H2 ↑
Fe2O3 ( r ) + 6HC l ( dd ) → 2F eCl3 ( dd ) + 3H2 O
FeO + H2SO4(loãng) → FeSO4 + H2O
CuO + 2HC l → CuCl2 + H2O
Tác dụng với muối
Khi cho Axit công dụng với muối sẽ tạo thành axit mới và muối mới, đây là phản ứng trao đổi. Trong đó điều kiện kèm theo xảy ra phản ứng là :
- Muối trước phản ứng là muối tan
- Sản phẩm thu được sau phản ứng phải có tối thiểu một chất kết tủa hoặc chất dễ bay hơi, dễ phân hủy hoặc những loại sản phẩm có tính axit yếu hơn axit bắt đầu
Ví dụ:
H2SO4 + BaCl2 → BaSO4 ↓ + 2HC l
K2CO3 + 2HC l → 2KC l + H2O + CO2 ↑ ( H2CO3 phân hủy ra H2O và CO2 )
2 HNO3 + K2S → 2KNO3 + 2 H2S ↑
6 HCl + Cu3 ( PO4 ) 2 → 3 CuCl2 + 2 H3PO4 ( yếu hơn HCl )
Ba ( NO3 ) 2 + H2SO4 → BaSO4 ↓ + 2HNO3

Acid nitric HNO3
Cách xác định độ mạnh, yếu của axit
Để xác lập đúng mực độ mạnh yếu của axit, ta địa thế căn cứ vào tính linh động của nguyên tử hydro trong cấu trúc phân tử của axit. Nguyên tử Hidro càng linh động thì tính axit càng mạnh và ngược lại .
Với những axit có oxy trong cùng một nguyên tố, càng ít oxy, axit càng yếu : HClO4 > HClO3 > HClO2 > HClO
Với những axit của nguyên tố trong cùng chu kỳ luân hồi, khi những nguyên tố ở hóa trị cao nhất, nguyên tố TT có tính phi kim càng yếu thì axit đó càng yếu : HClO4 > H2SO4 > H3PO4
Với axit của nguyên tố cùng nhóm A
- Axit có oxy : Tính axit tăng dần từ dưới lên : HIO4< HBrO4< HClO4
- Axit không có oxy : Tính axit giảm dần từ dưới lên : HI > HBr > HCl > HF
Với axit hữu cơ RCOOH
- Nếu R đẩy electron ( gốc R no ) thì tính axit giảm :HCOOH> CH3COOH> CH3CH2COOH> CH3CH2CH2COOH> n-C4H9COOH
- Nếu R hút e (gốc R không no, thơm hoặc có nguyên tố halogen,…), tính axit sẽ mạnh
>>Tham khảo: Hóa chất xử lý bể bơi
Ứng dụng quan trọng của axit trong cuộc sống
Axit đóng vai trò quan trọng trong nhiều nghành nghề dịch vụ của đời sống :
Ứng dụng của axit HCl
- Dùngaxit HClđể tẩy những vết han gỉ trên sắt thép trong công nghiệp sản xuất, giúp tiết kiệm chi phí ngân sách, thực thi với dung dịch HCl có nồng độ 18 % .
- HCl được ứng dụng trong ngành công nghiệp mạ và sản xuất pin
- Đây là loại axit dùng để tổng hợp những chất hữu cơ để sản xuất nhựa PVC, vật liệu được sử dụng rất nhiều trong đời sống hàng ngày của tất cả chúng ta .
- HCl có năng lực trấn áp kiềm mạnh, được sử dụng để trung hòa độ pH cho nước, đặc biệt quan trọng được sử dụng nhiều để vệ sinh nguồn nước ao hồ, những loại nước thải …
- HCl được ứng dụng trong ngành công nghệ tiên tiến thực phẩm : tạo ra những chất phụ gia …
>> Xem thêm: n-butanol
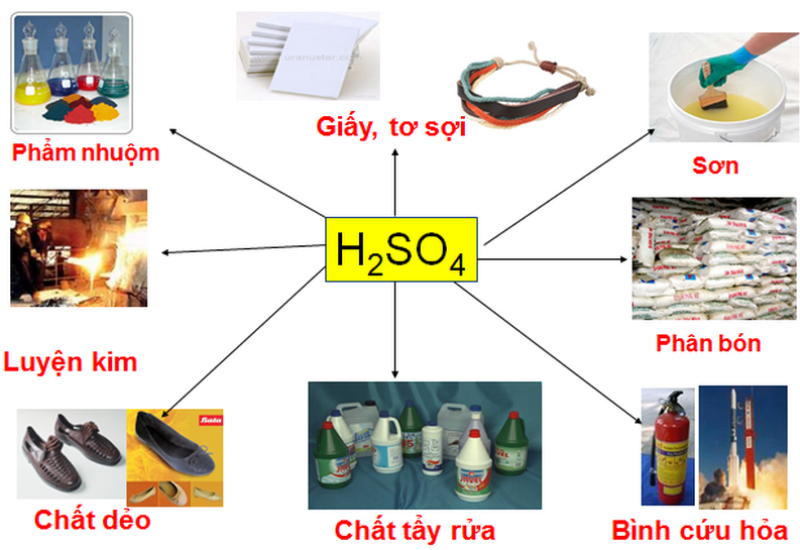
Ứng dụng của axit H2SO4
- H2SO4 đóng vai trò là nguyên vật liệu cũng như chất xúc tác trong sản xuất của nhiều ngành công nghiệp lúc bấy giờ .
- H2SO4 dùng để sản xuất H3PO4, nguyên vật liệu để sản xuất những loại phân bón, phân lân .
- Hỗn hợp axit với nước là chất điện giải trong công nghiệp sản xuất pin và ắc quy
- Axit sunfuric cũng có năng lực làm sạch và trung hòa độ pH cho nước .
- Ngoài ra, axit này được dùng trong 1 số ít nghành khác như tẩy rửa sắt kẽm kim loại trước khi mạ, sản xuất thuốc nổ, là nguyên vật liệu sản xuất những loại thuốc nhuộm, dược phẩm …
Ứng dụng của axit H3PO4
Hiện nay, người ta mua axit H3PO4 để sử dụng cho nhiều mục đích khác nhau, cụ thể như:
-
H3PO4 dùng để xử lý nước thả i theo phương pháp sinh học, giúp nguồn nước trong sạch tự nhiên, an toàn cho sức khỏe người sử dụng.
- H3PO4 đóng vai trò làm chất phụ gia trong sản xuất những loại bánh kẹo, thạch, mứt, nước ngọt, … mang lại mùi vị thơm ngon và đậm đà hơn cho từng loại sản phẩm .
- H3PO4 có năng lực chống cháy và oxy hóa tốt nên thường được tẩm vào những loại nội thất bên trong làm tăng độ bền và tính bảo đảm an toàn khi sử dụng
-
Trong nông nghiệp, H3PO4 là chất để sản xuất các loại phân bón, phân lân
Trên đây là những san sẻ của chúng tôi về tất tần tật những kiến thức và kỹ năng tương quan đến axit. Hy vọng bài viết sẽ phân phối cho những bạn những thông tin hữu dụng .
Sản phẩm axit khác: Axit Boric H3BO3; axit sulfamic; axit cromic; axit nitric; axit clohydric; axit oxalic; axit sunfuric
Tác giả : Admin
Source: https://dichvubachkhoa.vn
Category : Mua Bán Đồ Cũ
Có thể bạn quan tâm
- VSA 501 – Bằng chứng kiểm toán đối với các khoản mục và sự kiện đặc biệt
- Thu mua vải cây vải tồn kho vải thanh lý
- 10 chiến lược quản lý hàng tồn kho – Quản lý bán hàng và phát triển kinh doanh
- Gạch cao cấp giá rẻ tại Hậu Giang nên mua ở đâu đảm bảo uy tín?
- Phân tích tình hình quản trị hàng tồn kho tại một doanh nghiệp (công ty cổ phần – Tài liệu text
- Tồn kho an toàn ảnh hưởng thế nào đến chuỗi cung ứng?